Résumé : Le traitement de référence en première ligne des adénocarcinomes métastatiques de l’estomac a été, pendant plusieurs décennies, une bichimiothérapie à base de sels de platine avec une médiane de survie globale ne dépassant pas 1 an. Il y a 15 ans, l’étude TOGA montrait l’intérêt de rajouter le trastuzumab à cette bichimiothérapie pour les tumeurs avec un statut HER2 positif, qui devenait ainsi le premier biomarqueur pour le cancer de l’estomac. Ces dernières années, un nombre important de biomarqueurs ont démontré leur intérêt dans la sélection des patients pour un traitement par immunothérapie avec des anticorps anti-PD1 en cas de tumeurs PD-L1 positives ou dMMR/ MSI, ou par zolbetuximab pour les tumeurs claudine 18.2 positives. Ces médicaments, en association avec une bichimiothérapie, ont permis d’améliorer significativement la survie des patients.
L’immunothérapie avec les anticorps anti-PD1
1. Tumeurs HER2 négatives
Avec les résultats positifs de l’essai de phase III Checkmate 649, dont les données actualisées de suivi à 3 ans ont récemment été publiées [2], le nivolumab (anti-PD1) associé à une bichimiothérapie par fluoropyrimidine et oxaliplatine (FOLFOX/XELOX) a obtenu, en 2021, une autorisation de mise sur le marché (AMM) (et un remboursement en France en 2023) en première ligne (L1) pour les patients qui présentent un AOG métastatique, HER2 négatif, PD-L1 positif (“Combined Positive Score” [CPS] ≥ 5).
Par la suite, un 2e essai international de phase III, KEYNOTE 859 [3] a confirmé les bénéfices en termes de SG de l’association d’un anti-PD1 (pembrolizumab) à une bichimiothérapie par fluoropyrimidine + sel de platine pour les AOG métastatiques HER2 négatif. Dans cette étude, la médiane de SG était améliorée de façon significative dans le bras pembrolizumab (12,9 mois vs 11,5 mois ; HR: 0,78; p < 0,0001), avec un bénéfice en survie plus marqué pour les sous-groupes PD-L1 positif avec CPS ≥ 1 (médiane SG: 13 mois vs 11,4 mois; HR : 0,74 ; p < 0,0001), et CPS ≥ 10 (médiane SG: 15,7 mois vs 11,8 mois ; HR: 0,65; p < 0,0001). La publication de ces résultats a conduit à une AMM européenne en 2023 du pembrolizumab pour les tumeurs CPS ≥ 1, mais avec un remboursement en France accordé en 2024 uniquement pour les tumeurs CPS ≥ 10, pour lesquelles le bénéfice en survie était plus important.
Plus récemment, l’étude internationale RATIONALE 305 a également montré l’efficacité d’un autre anticorps anti-PD1, le tislelizumab, en association avec une bichimiothérapie à base de sels de platine. La médiane de SG en population globale (objectif principal) passait de 12,9 à 15 mois (HR: 0,80; p = 0,001), avec cependant, un bénéfice plus important pour les tumeurs PD-L1 positives avec “Tumor Area Positivity” (TAP) ≥ 5 % (12,6 vs 17,2 mois ; HR : 0,74 ; p = 0,006) [4]. Une AMM pour le tislelizumab a été accordée en 2024 pour les tumeurs TAP ≥ 5 % mais le remboursement est en attente en France.
Ainsi, sur la base de ces trois essais internationaux de phase III, l’association bichimiothérapie (fluoropyrimidine +sel de platine) + anticorps anti-PD1 doit donc être considérée comme un standard thérapeutique en L1 des AOG métastatiques HER2 négatif, avec surexpression significative de PD-L1 (tableau I).
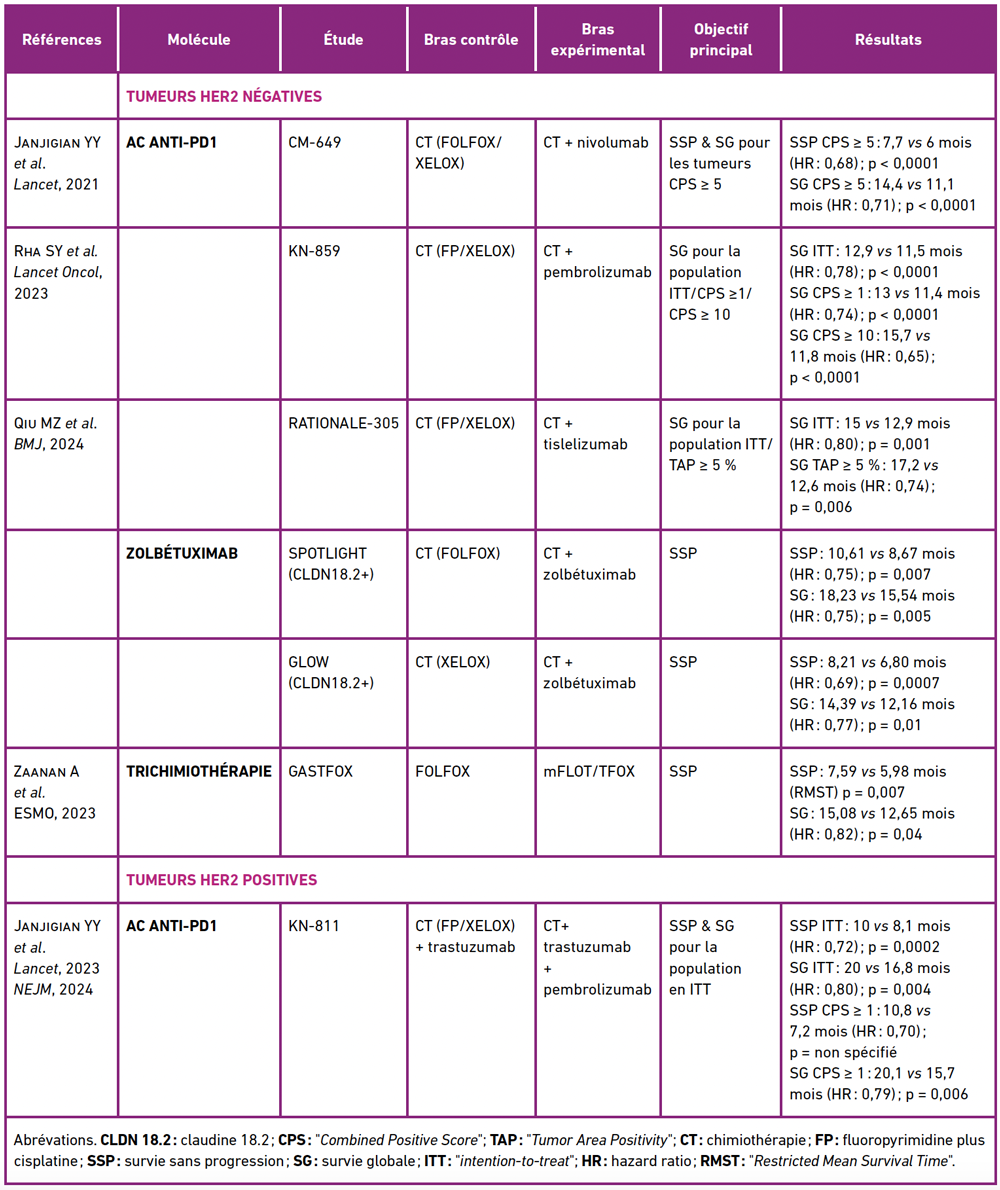
Tableau 1 : Résultats des principaux essais positifs de phase III en 1re ligne de traitement des adénocarcinomes œsogastriques métastatiques.
Cette stratégie thérapeutique est également celle de choix pour les AOG métastatiques dMMR/MSI. En effet, les analyses de sous-groupes de ces trois essais randomisés ont montré un bénéfice en survie très largement en faveur du bras immunothérapie pour les tumeurs dMMR/MSI [4][5][6]. Cependant, en l’absence d’étude randomisée dédiée spécifiquement à cette population de patients, il n’existe ni AMM, ni remboursement en France pour le traitement en 1re ligne par immunothérapie des AOG métastatiques MSI/dMMR. À noter toutefois que la majorité des tumeurs MSI ont un niveau d’expression élevé de PD-L1, permettant ainsi d’accéder à l’immunothérapie par le biais de ces indications.
2. Tumeurs HER2 positives
Jusqu’à récemment, le standard en 1re ligne des AOG métastatiques HER2 positif (IHC3+ ou IHC2+/FISH+) était l’association d’une bichimiothérapie (fluoropyrimidine et sel de platine) au trastuzumab (anticorps monoclonal anti-HER2).
L’essai international de phase III KEYNOTE-811 avait pour objectif d’étudier en L1 l’association du pembrolizumab au traitement standard de l’AOG métastatique HER2 positif. Au total, 698 patients ont été inclus : 350 dans le bras pembrolizumab, 348 dans le bras placebo, et ont été randomisés (1:1) entre pembrolizumab + trastuzumab + chimiothérapie ou placebo + trastuzumab + chimiothérapie. L’objectif principal, qui était double avec l’amélioration de la survie sans progression (SSP) et de la SG en population globale, a été atteint avec cependant des analyses de sousgroupes préplanifiées en faveur de l’immunothérapie pour les tumeurs CPS > 1 mais pas pour les tumeurs CPS < 1 [7][8] (tableau I). Sur la base de ces résultats, le pembrolizumab a eu une AMM en 2023 pour le traitement en L1 des tumeurs HER2 positives avec CPS ≥ 1, mais le remboursement en France n’est toujours pas effectif début 2025.
Ainsi, l’association pembrolizumab + trastuzumab + chimiothérapie devient donc un standard thérapeutique en L1 pour les AOG métastatiques HER2 positif avec CPS ≥ 1, même si le remboursement se fait toujours attendre en 2025.
L’arrivée récente du zolbétuximab pour les tumeurs claudine 18.2 positives
La Claudine 18.2 est une protéine de jonction serrée située principalement dans l’épithélium gastrique non tumoral et qui devient accessible à la surface des cellules tumorales au cours de la transformation maligne. Deux essais internationaux de phase III ont été récemment publiés démontrant le bénéfice de l’association d’un inhibiteur de la claudine 18.2 (zolbétuximab) à une bichimiothérapie (fluoropyrimidine et oxaliplatine) en première ligne des AOG métastatiques HER2 négatif et surexprimant la claudine 18.2 (immunomarquage IHC2 + ou 3 + pour plus de 75 % des cellules tumorales) (tableau I) [9][10] .
L’essai de phase III SPOTLIGHT [9] a comparé chez 565 patients surexprimant la claudine 18.2 (= 38% des patients screenés) un traitement par FOLFOX +placebo vs FOLFOX +zolbétuximab (dose initiale de 800 mg/m2 puis 600 mg/m2 toutes les 3 semaines). L’étude était positive pour son critère de jugement principal, avec une médiane de SSP de 10,61 mois dans le bras zolbétuximab vs 8,67 mois dans le bras placebo (HR: 0,75; p = 0,0066). Le bénéfice était également significatif en SG en faveur de l’association avec le zolbétuximab (médiane: 18,23 mois vs 15,54 mois; HR: 0,75; p =0,0053).
Ces résultats ont été confirmés dans l’étude GLOW [10] qui comparait l’association CAPOX + zolbétuximab à la chimiothérapie seule dans la même indication que celle de l’étude SPOTLIGHT. Les médianes de SSP (objectif principal) (8,21 mois vs 6,80 mois ; HR: 0,687; p = 0,0007) et de SG (14,39 mois vs 12,16 mois ; HR: 0,771; p = 0,0118) étaient également améliorées de façon significative.
Le zolbétuximab vient donc renforcer l’arsenal thérapeutique en 1re ligne des AOG métastatiques HER2 négatif et claudine 18.2 positive avec l’obtention d’une AMM européenne en septembre 2024. En attendant le remboursement de ce médicament, l’HAS a autorisé un accès précoce depuis janvier 2025.
Quelle stratégie en 1re ligne en l’absence de cible moléculaire actionnable?
En l’absence de cible actionnable ESCAT IA identifiée en L1, depuis la communication des résultats de l’essai académique de phase III français GASTFOX [11] lors du congrès de l’ESMO 2023, le triplet docétaxel + fluorouracile +oxaliplatine (TFOX/mFLOT) devient une indication thérapeutique en 1re ligne pour les patients avec un AOG métastatique HER2 négatif triple négatif (pMMR/MSS, PD-L1 et claudine 18.2 négatifs).
Parmi les 507 patients inclus dans l’essai GASTFOX, le traitement par mFLOT/ TFOX vs FOLFOX permettait une amélioration significative de la SSP (objectif principal) avec une médiane passant de 5,98 à 7,59 mois (RMST, p = 0,007) et de la SG (médiane : 15,08 mois vs 12,65 ; HR: 0,82; p = 0,048). Le bénéfice en survie était plus marqué pour les patients jeunes (< 65-70 ans), ECOG PS 0, ou avec un adénocarcinome à cellules indépendantes/forme diffuse [11]. Ainsi, en l’absence de cible actionnable, le schéma TFOX est donc une option thérapeutique pour les patients éligibles à une intensification par trichimiothérapie (tableau I).
Conclusion et perspectives
L’arsenal thérapeutique s’est enrichi ces dernières années pour le traitement de 1re ligne des AOG métastatiques avec l’avènement de l’immunothérapie, du zolbétixumab et du TFOX. Actuellement, de nouvelles autres cibles thérapeutiques d’intérêt sont en cours de développement. Par exemple, les amplifications de FGFR (fibroblast growth factor receptor), retrouvées dans environ 5-10 % des AOG, font l’objet d’études évaluant des inhibiteurs spécifiques tels que le bémarituzumab. Cet anticorps monoclonal anti-FGFR2b a été testé dans des études de phase II en combinaison avec le FOLFOX en montrant des résultats encourageants. Deux essais de phase III évaluent actuellement le bémarituzumab en L1 de l’AOG métastatique avec surexpression FGFR2b en association avec la chimiothérapie (FORTITUDE-101 ; NCT05052801) ± nivolumab (si CPS ≥ 5) (FORTITUDE-102; NCT05111626).
De plus, de nouveaux inhibiteurs d’HER2 pour les AOG métastasiques HER2 positifs sont en cours d’évaluation en 1re ligne, dont les futurs résultats seront à suivre (zanitadamab, un anticorps bispécifique ciblant deux épitopes non chevauchants de HER2 dans l’essai HERIZON-GEA-01, NCT05152147 ; margétuximab dans l’essai MAHOGANY, NCT04082364 ; tucatinib dans l’essai SGNTUC-024, NCT04430738).
De nouveaux anticorps bispécifiques sont également en cours de développement ou sont à l’étude et marqueront sans doute l’avenir des stratégies thérapeutiques de l’AOG métastatique (par exemple, cadonilimab : anticorps bispécifique anti-PD1/anti-CTLA4 évalué en L1 dans l’essai de phase III asiatique COMPASSION-15 (NCT05008783) ; IBI315: anticorps bispécifique anti-PD1/ anti-HER2).
Par ailleurs, des études de stratégie permettront à l’avenir de mieux hiérarchiser ces biomarqueurs ou d’évaluer l’intérêt de combiner les thérapies ciblées avec l’immunothérapie pour les patients surexprimant plusieurs biomarqueurs.
BIBLIOGRAPHIE
-
1.
A framework to rank genomic alterations as targets for cancer precision medicine: the ESMO Scale for Clinical Actionability of molecular Targets (ESCAT). Ann Oncol, 2018;29:1895-1902.
-
2.
First-line nivolumab plus chemotherapy for advanced gastric, gastroesophageal junction, and esophageal adenocarcinoma: 3-year follow-up of the phase III checkmate 649 trial. JCO, 2024;42:2012-2020.
-
3.
Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for HER2-negative advanced gastric cancer (KEYNOTE-859): a multicentre, randomised, double-blind, phase 3 trial. Lancet Oncol, 2023;24:1181-1195.
-
4.
Tislelizumab plus chemotherapy versus placebo plus chemotherapy as first line treatment for advanced gastric or gastro-oesophageal junction adenocarcinoma: RATIONALE-305 randomised, double blind, phase 3 trial. BMJ, 2024;385:e078876.
-
5.
First-line nivolumab plus chemotherapy for advanced gastric, gastroesophageal junction, and esophageal adenocarcinoma: 3-year follow-up of the phase III checkmate 649 trial. J Clin Oncol, 2024;42:2012-2020.
-
6.
Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for HER2-negative advanced gastric cancer (KEYNOTE-859): a multicentre, randomised, double-blind, phase 3 trial. Lancet Oncol, 2023;24:1181-1195.
-
7.
Pembrolizumab plus trastuzumab and chemotherapy for HER2-positive gastric or gastro-oesophageal junction adenocarcinoma: interim analyses from the phase 3 KEYNOTE-811 randomised placebo-controlled trial. Lancet, 2023;402:2197-2208.
-
8.
Pembrolizumab in HER2-positive gastric cancer. N Engl J Med, 2024;391: 1360-1362.
-
9.
Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial. The Lancet, 2023;401: 1655-1668.
-
10.
Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial. Nat Med, 2023;29:2133-2141.
-
11.
5-fluorouracil and oxaliplatin with or without docetaxel in the first-line treatment of HER2 negative locally advanced (LA) unresectable or metastatic gastric or gastro-esophageal junction (GEJ) adenocarcinoma (GASTFOX-PRODIGE 51): A randomized phase III trial sponsored by the FFCD. Ann Oncol, 2023;34.
-
Aziz Zaanan (consultant/advisory board member) a déclaré les liens d’intérêts suivants : Amgen, Astellas, Merck, Roche, Servier, MSD, BMS, Pierre Fabre, Daiichi Sankyo, Astra Zeneca, Bayer, BeiGene, Gilead, Abbvie.




